研究倫理審査申請
研究倫理違反に関する通報窓口
「研究活動における不正行為への対応等に関するガイドライン」及び「研究機関における公的研究費の管理・監査のガイドライン」にある基準等を踏まえ、日本障害者歯科学会に係る研究活動の不正行為並びに、研究費の不正使用及び不正受給に関する告発受付窓口を設置しました(倫理委員会)。
窓口:メールアドレス( jsdh@kokuhoken.or.jp )
標題:【研究活動の不正に関する報告】としてください。
研究活動の不正行為、研究費の不正使用・受給に関する専門窓口への報告事項は以下のとおりです。
・匿名告発か顕名(告発者の氏名・連絡先)告発のどちらかを希望する
・不正を行ったとする研究者・グループ、
・不正行為や不正使用・受給の態様(内容や年度等を含む)、
・不正行為とする科学的根拠あるいは不正使用・受給とする根拠、
・使用された研究費
*調査にあたって告発者に協力を求める場合があります。また、調査の結果、告発側の悪意に基づく告発であった場合は、処罰・告発等の対象となりうることを申し添えます。
研究倫理申請に関するお知らせ
第36回日本障害者歯科学会(2019年)より介入研究などの演題で研究倫理申請および倫理講習の受講が必要になります.
倫理的にも科学的にも問題のない形で研究の遂行をお願いします.
本委員会としては,その臨床研究がより良い形になるよう支援していきます.
- 主任研究者が倫理委員会の設置されている機関(大学・病院)に所属している場合。臨床研究の開始前に所属する機関に研究を申請してください.
- 主任研究者が倫理委員会の設置がない機関(センター・一般開業医ほか)に所属している場合は,本学会での倫理申請が必要です.
- 倫理審査申請書の提出の締め切りは3月末,7月末,11月末の年3回です。
- 臨床研究倫理審査申請の要領
参照:「研究倫理審査申請について」 - 倫理講習(e-ラーニング)の受講および研究倫理審査申請の詳細については下記をご覧ください.
参照:倫理講習e-ラーニングの受講のご案内
研究倫理審査申請について
はじめに
研究臨床研究を行うことで新たな知見が得られることは,医療の発展に非常に重要なことであるのみならず,患者さんにも還元されて大変素晴らしいことです.しかし,患者の健康を守るべき医師が,医学研究の美名のもとにナチスの人体実験に協力したことの反省から,世界医師会は1964年ヘルシンキ宣言を採択し,患者(被験者)の福利の尊重や,自由意志による参加,インフォームド・コンセントの取得,および倫理審査委員会の設置などを謳いました.我が国もこれにならって倫理指針が検討され,厚生労働省は被験者保護の立場から平成15年に臨床研究に関する倫理指針を発表し,平成16年および20年に全面改定を行いました(施行は21年4月).
さらに, 平成26年12月に文部科学省と厚生労働省が合同で「人を対象とする医学系研究に関する倫理指針」を制定し, 平成29年2月に一部改正されました.それによると研究対象者の生命,健康および人権を尊重して,研究を実施しなければならない.また,人を対象とする医学系研究を行う研究者等は,研究計画書を立てて,倫理審査委員会の審査を受け承認されてから.研究を開始することが求められています.さらに,平成30年4月に臨床研究法が施行されました.
本学会もこれらの指針・法律を遵守し,それに沿う形で学会発表や論文発表が行わなければなりません. つまり,研究開始前に研究倫理申請をしていただき, 倫理的にも科学的にも問題のない形で研究の遂行が必要になります. そのためにも,倫理審査委員会がない所属機関や一般開業医・歯科衛生士など本学会員の方々は,是非とも研究計画を立てた時点で本学会倫理委員会に臨床研究倫理審査申請を行うようにお願いいたします.本委員会としては,その臨床研究がより良い形になるよう支援していきます.
令和元年9月
一般社団法人日本障害者歯科学会
倫理委員会
参考
- 人を対象とする生命科学・医学系研究に関する倫理指針(本文)(令和5年3月27日一部改正)
- 人を対象とする生命科学・医学系研究に関する倫理指針ガイダンス(令和3年4月16日)
- 臨床研究法(平成29年4月14日公布、平成30年4月1日施行)
臨床研究倫理審査申請の要領
1.主任研究者が倫理審査委員会の設置されている機関(大学・病院)に所属している場合
臨床研究の開始前に所属する機関に研究を申請する.なお, 共同研究者の場合はその限りでない.
2.倫理審査委員会が設置されていない機関(一般開業医ほか)に所属している場合
臨床研究の開始前に本倫理審査委員会に研究を申請する.
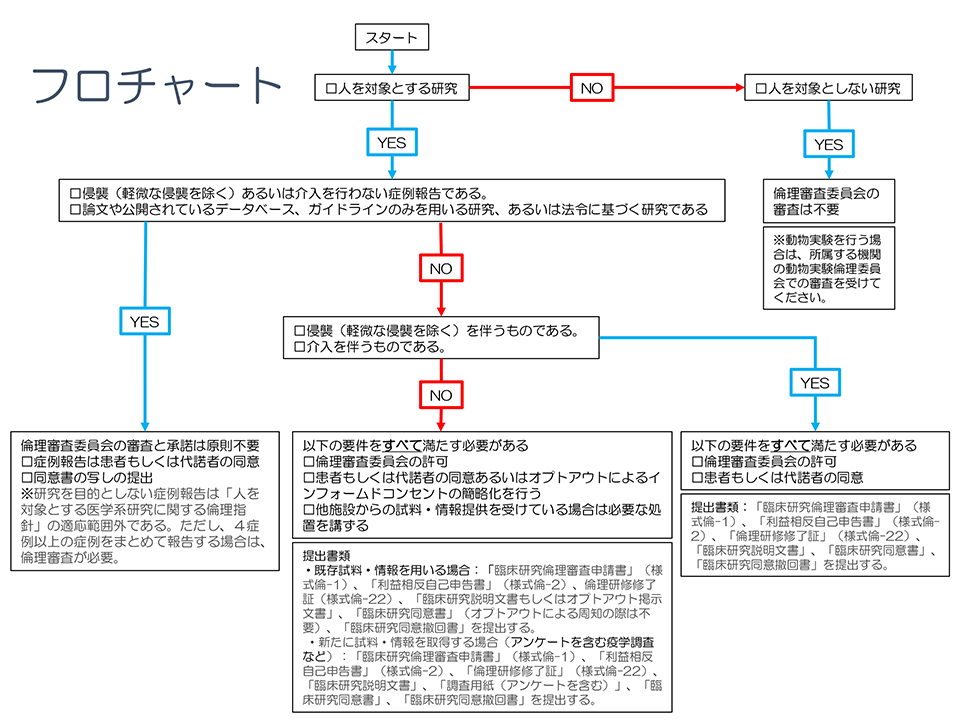
1)侵襲を伴う研究または介入を行う研究
研究計画を立案し,本倫理委員会に「臨床研究倫理審査申請書」,「同意書見本」,「利益相反自己申告書」,「倫理研修修了証」およびその他必要書類を提出する.
対象者あるいはその代諾者の文書によるインフォームド・コンセント(IC)が必須である.
2)観察研究(介入をともなわない研究)
(1)既存試料・情報を用いる研究
研究計画を立案し,本倫理委員会に「臨床研究倫理審査申請書」,「同意書見本」,「利益相反自己申告書」,「倫理研修修了証」およびその他必要書類を提出する.患者もしくは代諾者の同意が原則必要であるが、状況によりオプトアウトによるICの簡略化を行うことが可能である.
(2)新たに試料・情報を取得して行う研究
研究計画を立案し,本倫理委員会に「臨床研究倫理審査申請書」,「同意書見本」,「利益相反自己申告書」,「倫理研修修了証」およびその他必要書類を提出する.
人体から取得された試料を用いる研究の場合,必ずしも文書によりICを得ることを要しないが,文書によりICを得ない場合には、口頭によりICを行い,その内容の記録を作成しなければならない.
原則として倫理審査委員会の許可とICが必要だが,ICを得ることが実質的に困難な場合は,オプトアウトによる手続きが可能である.
3)症例報告
症例報告では個人情報保護法および関連法令等を遵守しなければならない.
患者自身(またはその代諾者)から同意を得る.その複写を本倫理委員会に提出する.
研究を目的としない症例報告は「人を対象とする医学系研究に関する倫理指針」の適応範囲外である.
症例報告における個人情報保護の配慮
「個人情報」,「個人情報等」および「個人識別符号」は記載しない.
患者の住所は記載しない.
日付は,個人が特定できないと判断される場合は年月までを記載してよい.
他の情報と照合することにより患者が特定され得る場合,診療科名は記載しない.
既に他院などで診断・治療を受けている場合,その施設名や所在地を記載しない.
顔写真を提示する際には目を隠す.
画像等を示す際は,症例を特定する番号などを削除する.
以上のほか,個人を特定できるものは配慮する.
臨床研究倫理審査申請の方法
上記の臨床研究で (1)介入研究および (2)観察研究に該当する場合は,当学会倫理審査委員会にメールにて申請する.申請書類提出先:日本障害者歯科学会事務局(jsdh@kokuhoken.or.jp)
必要書類
| 1) 臨床研究倫理審査申請書(必須, 様式倫-1) | 押印なしのままWordファイルでお送り下さい。 |
| 2) 利益相反自己申告書(必須, 様式倫-2) | PDF等でお送り下さい。 |
| 3) 倫理研修修了証(必須,様式倫-22) | PDF等でお送り下さい。 |
| 4) 同意書見本(必要に応じて) | Wordファイルでお送り下さい。 |
| 5) 同意撤回書(必要に応じて) | Wordファイルでお送り下さい。 |
その他、必要書類があれば提出してください
※必要事項を記入のうえ, 学会事務局に申請書等の書類をメールにて提出してください(最終版は郵送でご提出いただきます).受付確認の返信をしますので、返信がない場合にはご一報ください.
※申請締め切り:3月末, 7月末, 11月末の年3回が申請提出の締め切り
なお, 倫理審査承認後に研究内容に変更があった場合には, すみやかに研究内容変更申請書(様式3)を提出する.
利益相反状態も変更になった場合は, 利益相反自己申告書の提出をお願いすることがある.
臨床研究同意説明文または同意書の記載事項
臨床研究の内容に応じて変更は可能である.参考にそれぞれ例文を掲載した.
- 研究の意義,目的
- 研究の実施方法,期間
- 研究参加により予想される利益,不利益,危険性
- 健康被害が生じた場合の治療や補償
- 当該臨床研究への参加は任意であること
- 研究不参加,途中中止でも不利益な対応を受けないこと
- 個人情報の保護
- 第三者(分析者など)によるデータの閲覧
- 被験者として選定された理由
- 研究中止時の条件,理由
- 被験者の遵守事項
- 被験者の費用負担,経済的利益
- 研究者などの氏名および職名
- 被験者または代諾者の署名,同意日付
- 説明者の署名,説明日付
- その他必要事項
研究倫理審査の全体の流れ
用語の定義
- 人を対象とする医学系研究
- 人(試料・情報を含む)を対象として,傷病の成因(健康に関する様々な事象の頻度及び分布並びにそれらに影響を与える要因を含む.)及び病態の理解並びに傷病の予防方法並びに医療における診断方法及び治療方法の改善または有効性の検証を通じて,国民の健康の保持増進または患者の予後もしくは生活の質の向上に資する知識を得ることを目的として実施される活動をいう.
- 侵襲
- 研究目的で行われる,穿刺,切開,薬物投与,放射線照射,心的外傷に触れる質問等によって,研究対象者の身体又は精神に障害又は負担が生じること.侵襲のうち,研究対象者の身体及び精神に生じる障害及び負担が小さいものを「軽微な侵襲」という.
- 介入
- 研究目的で,人の健康に関する様々な事象に影響を与える要因(健康の保持増進につながる行動,傷病の予防,診断や治療のための投薬・ 検査等)を制御する行為を行うこと.介入を行うことが必ずしも侵襲を伴うとは限らない.通常の診療を超える医療行為であって,研究目的で実施するものを含む.
- 既存試料・情報
- 研究計画書が作成されるまでに既に存在する試料・情報.研究計画書の作成以降に取得された試料・情報であって,取得の時点においては当該研究計画書の研究に用いられることを目的としていなかったもの.
具体例:抜去歯,診療録 - 新たに取得する試料・情報
- 「既存試料・情報」以外の試料・情報.当該研究に用いるために研究対象者から直接取得するもの.医療に上乗せして,あらかじめ研究を目的として研究対象者から直接取得するもの.
- 個人情報
- 氏名,生年月日その他の記述等により特定の個人を識別することができるもの(他の情報と照合することができ,それにより特定の個人を識別することができることとなるものを含む).
- 要配慮個人情報
- 人種,信条,社会的身分,病歴,犯罪の経歴,犯罪により害を被った事実,その他本人に対する不当な差別や不利益が生じないようにその取扱いに特に配慮を要する記述等が含まれる個人情報(診療録,レセプト,健診結果など)をいう.
- 匿名化
- 特定の個人を識別することができることとなる記述等(個人識別符号を含む)の全部又は一部を削除すること(当該記述等の全部又は一部を当該個人と関わりのない記述等に置き換えることを含む)をいう.
※改正により「連結不可能匿名化」/「連結可能匿名化」の用語が廃止された. - 対応表
- 匿名化された情報から,必要な場合に研究対象者を識別することができるよう,当該研究対象者と匿名化の際に置き換えられた記述等とを照合することができるようにする表その他これに類するものをいう.
- 匿名加工情報(非識別加工情報)
- 措置を講じて特定の個人を識別することができないように個人情報を加工して得られる個人に関する情報であって,当該個人情報を復元することができないようにしたものをいう.
- インフォームド・コンセント
- 研究対象者又はその代諾者等が,研究目的及び意義並びに方法,負担,結果等について十分な説明を受け,自由意思に基づいて研究者等に対し与える同意をいう.
- インフォームド・アセント
- 未成年者等を研究対象者とする場合,親権者等のインフォームド・コンセントに加えて,研究対象者本人にも理解力に応じた分かりやすい説明を行い,研究についての賛意(インフォームド・アセント)を得るように努める.
- オプトアウト
- 当該研究について情報を研究対象者等に直接通知するか,又は当該施設の掲示板やホームページ上で公開し,研究対象者等が研究への参加を拒否する機会を保障すること.
臨床研究倫理審査申請書類一覧
申請書類の提出は,メールの件名に「日本障害者歯科学会倫理審査委員会宛て」と記入し,メール添付にて提出してください.申請書類提出先:日本障害者歯科学会事務局(jsdh@kokuhoken.or.jp)
※様式倫-1,4,5,6,7,8,9,12,13は、Wordファイルのままご提出ください。